Две инактивированные вакцины против COVID-19, разработанные китайским фармацевтическим гигантом Sinopharm, оказались безопасными и эффективными, говорится в исследовании по итогам третьей фазы клинических испытаний данных препаратов на людях, опубликованном на этой неделе в Журнале Американской медицинской ассоциации /JAMA/.
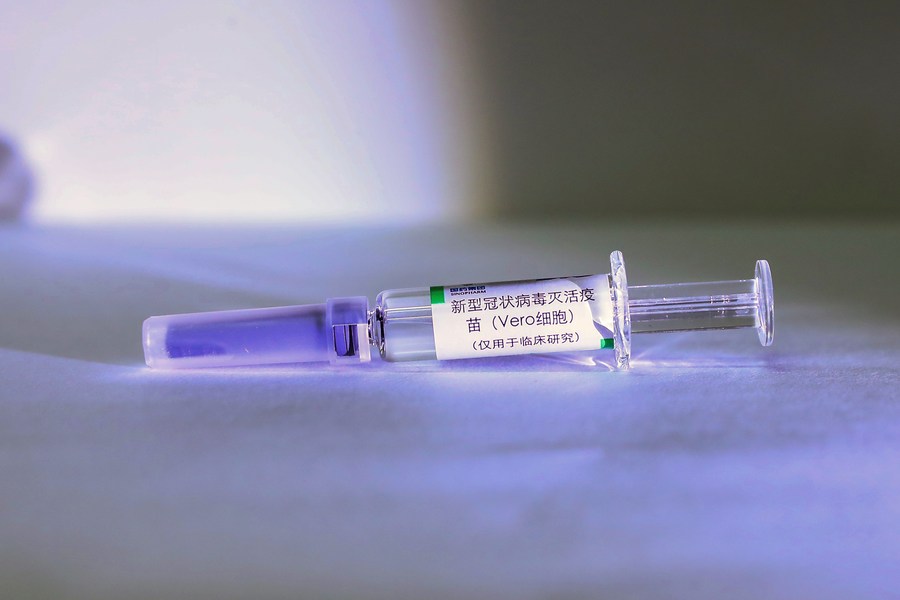
10 апреля 2020 года, образец шприца с инактивированной вакциной против COVID-19, выпускаемой на производственной базе компании Sinopharm в Пекине. /Фото: Синьхуа/
Результаты исследования основаны на промежуточном анализе испытаний двух новых вакцин в рамках третьей фазы, представленных в виде рандомизированных, двойных слепых и плацебо-контролируемых испытаний. Они были проведены институтами Wuhan Institute of Biological Products Co, Ltd и Beijing Institute of Biological Products Co, Ltd. Оба института принадлежат компании China National Biotec Group /CNBG/, аффилированной с Sinopharm.
Это первые в мире опубликованные результаты третьей фазы испытаний инактивированных вакцин против COVID-19, говорится в заявлении CNBG.
Как сообщается, в испытаниях приняли участие более 40 тыс. человек из зарубежных стран в возрасте 18 лет и старше. Участники испытаний получили две дозы вакцины путем внутримышечной инъекции с интервалом в 21 день.
Для разработки двух инактивированных вакцин были использованы штаммы вируса, которые были выделены у двух пациентов в больнице Цзиньиньтань в г. Ухань /пров. Хубэй, Центральный Китай/, назначенной для лечения заболевших COVID-19.
14 дней спустя после получения второй дозы вакцины у всех вакцинированных выработались высокие титры антител, а коэффициент конверсии нейтрализующих антител составил более 99 проц., что свидетельствует о сильном иммунном ответе, вызванном этими двумя вакцинами.
29.05.2021
Источник: Агентство Синьхуа = http://russian.news.cn/2021-05/27/c_139973642.htm